Las estructuras de Lewis son modelos que usan símbolos de los elementos, puntos y rayas para representar la distribución de los electrones de valencia en un átomo o en una molécula.


El número atómico del carbono es 6, por tanto, tiene 6 electrones.
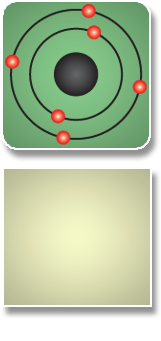

Estos 6 electrones se distribuyen en órbitas.


Del modelo atómico se observa que el carbono tiene 4 electrones de valencia.

Al carbono le faltan 4 electrones para completar su octeto, estos los obtendrá al formar enlaces con otros elementos.
En la estructura de Lewis de una molécula se debe considerar que todos los átomos cumplan con la regla del octeto, para ello se deben seguir las siguientes reglas:

El hidrógeno tan solo se rodea de 2 electrónes para tener la configuración del helio.

Si el enlace entre dos átomos es covalente, entonces se usa un guion o línea para representar al par de electrones compartidos en el enlace.

Los pares de electrones no compartidos se representan con dos puntos.

Cuando se forma un enlace iónico no se dibuja un guion entre los átomos, ya que no comparten el par de electrones; en cambio, se indica la carga de los iones.
Haz la estructura de Lewis del tetracloruro de carbono CCl4, para ello, básate en los modelos atómicos del cloro y carbono. Observa en la fórmula que solo hay un átomo de carbono y cuatro de cloro.
Cloro
Carbono
Electrón








































Ahora haz las estructuras de Lewis para el agua (H2O) y el cloruro de
sodio (NaCl).
Cloro
Sodio
Oxigeno
Hidrogeno
Electrón
Enlace